Как устроены ВИЧ и АРВТ? Объясняем на пальцах
Вирусы довольно трудно «убить» в обычном понимании этого слова, потому что они обладают лишь немногими признаками живого, важнейший из которых — способность размножаться.
За пределами организма вирусную частицу можно разрушить с помощью агрессивных химических веществ — дезинфицирующих средств или антисептиков. Но после того как вирус проник в организм, остается только один вариант «убить» его — заблокировать размножение.
Вирусы могут размножаться только внутри клетки-хозяина, перестраивая ее работу так, что клетка начинает производить новые вирусные частицы. Это серьезно нарушает работу самой клетки и в большинстве случаев ведет к ее гибели. Процесс проникновения и размножения вируса в ней сложный и содержит много стадий, а значит, специальные лекарства могут тормозить его на различных этапах.
В случае с ВИЧ это выглядит так.
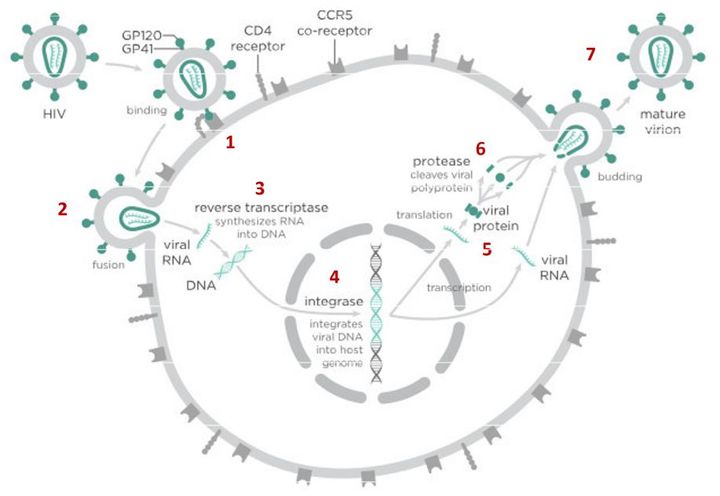
На первом этапе (цифра 1 на схеме) вирус проникает в клетку. Чтобы попасть внутрь, вирусной частице сначала необходимо «прилипнуть» к поверхности клетки. Для ВИЧ таким «клеем» является специальный белок gp120, который находится на поверхности вирусной частицы. Этот белок «приклеивается» к рецепторам CD4, расположенным на поверхности Т-лимфоцитов (Т-хелперов) и некоторых других клеток. Если у клетки нет рецептора CD4, то частица ВИЧ не может удержаться на ее поверхности и проникнуть внутрь, поэтому ВИЧ поражает только определенные типы клеток, имеющие этот рецептор. Например, некоторые Т-лимфоциты.
На этом самом первом этапе инфицирования клетки заблокировать процесс может ибализумаб — недавно зарегистрированный в США новый препарат против ВИЧ. Ибализумаб связывается с рецептором CD4 и мешает нормальному взаимодействию вирусного белка gp120 с ним. Из-за этого вирус не «прилипает» к клеткам-мишеням и не может в них проникнуть.
После «прилипания» к рецептору CD4 клетки-хозяина вирусная частица взаимодействует еще с одним рецептором — CCR5 (или с CXCR4 — в зависимости от типа вируса), чтобы лучше закрепиться на поверхности клетки. На этом этапе работает другой препарат против ВИЧ — маравирок. Молекула этого лекарства связывается с рецептором CCR5 и блокирует его, что не позволяет вирусу перейти к следующему этапу проникновения в клетку и останавливает заражение. Но у этого вещества есть недостаток — дело в том, что некоторые типы вируса иммунодефицита человека используют на втором этапе другой рецептор — CXCR4. Такому вирусу маравирок не помешает проникнуть в клетку.
После того как вирусная частица приклеилась к рецепторам CD4 и CCR5/CXCR4 и закрепилась на поверхности клетки, другой специальный белок вируса gp41 соединяет оболочку вируса с мембраной клетки-мишени и помогает вирусу проникнуть внутрь клетки (цифра 2 на схеме). На этом этапе остановить вирус может другая группа препаратов — ингибиторы слияния, например, энфувиртид. Препарат связывается с вирусным белком gp41 и нарушает его работу.
Следующий важный этап (на схеме обозначен цифрой 3) — обратная транскрипция. Для того чтобы клетка начала производить вирусные частицы, вирус должен встроить свою генетическую информацию в ДНК клетки-хозяина. Однако у ВИЧ все гены хранятся не в ДНК, как у людей, а в РНК. Поэтому вирус с помощью специального фермента — обратной транскриптазы — сначала должен переписать свои гены из собственной РНК в понятную нашим клеткам ДНК. Обратная транскриптаза работает как конвейер: захватывает отдельные нуклеозиды — строительные «кирпичики», из которых складывается ДНК, — и собирает их в готовую цепочку. А нужная (для воспроизводства вируса) последовательность кирпичиков-нуклеозидов при этом записана в исходной вирусной РНК.
На этом этапе размножение вируса блокирует очень большое количество препаратов из двух классов — нуклеозидные ингибиторы обратной транскриптазы (НИОТ — ламивудин, абакавир, тенофовир) и ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ — эфавиренз, рилпивирин). Принцип действия у веществ из обеих групп похожий: молекула лекарства связывается с обратной транскриптазой вируса, нарушает ее работу и так блокирует перенос генов вируса из РНК в ДНК. Это не позволяет генам вируса встроиться в ДНК клетки-хозяина и начать производство новых вирусных частиц.
Разница между НИОТ и ННИОТ заключается в структуре молекул лекарств. Вещества первой группы по структуре похожи на нуклеозиды — те самые кирпичики, из которых строятся молекулы ДНК и РНК. Когда такой «неправильный кирпичик» попадает в «конвейер» обратной транскриптазы вируса, ее механизм «заклинивает», и она больше не может собирать вирусную ДНК. ННИОТ имеют другую структуру, непохожую на нормальные нуклеозиды, и блокируют обратную транскриптазу, связываясь с ее молекулой в других точках.
С этой особенностью строения связано и большее число побочных эффектов при приеме НИОТ по сравнению с ННИОТ: молекулы первого класса ингибиторов могут нарушать процессы синтеза РНК и ДНК и в наших собственных клетках, так как они похожи на «нормальные» нуклеозиды и тоже «заклинивают» наши собственные ферменты, но в гораздо меньшей степени, чем вирусные. НИОТ исторически были первым классом препаратов, которые начали использовать для лечения ВИЧ-инфекции.
На следующем этапе инфицирования (цифра 4 на схеме) готовая вирусная ДНК проникает в ядро и встраивается в ДНК клетки-хозяина с помощью специального вирусного фермента — интегразы. Работу этого фермента блокируют ингибиторы интегразы, например, долутегравир, не позволяя ДНК вируса встроиться в наши гены.
После того как вирусная ДНК встраивается в ДНК клетки-хозяина, клетка получает неправильную программу и начинает производить вирусные белки и РНК, необходимые для сборки новых частиц вируса (цифра 5 на схеме), используя для этого структуры, которые в норме производят собственные белки клетки. Такая перенастройка производства белка сильно нарушает работу клетки и через некоторое время вызывает ее гибель. Лекарств, которые бы влияли на этот этап размножения вируса, нет, так как здесь вирус использует собственные ферментные системы клетки-хозяина и блокирование их работы какими-то веществами навредит здоровым клеткам.
После синтеза вирусных белков клеткой-хозяином в работу вступает еще один фермент вируса — протеаза (цифра 6 на схеме). Дело в том, что белки ВИЧ синтезируются в виде длинных цепочек белков-предшественников, но они неактивные. Протеаза разрезает эти цепочки на более короткие фрагменты, которые становятся активными белками вируса: из одних собирается вирусная оболочка, другие выполняют функции ферментов (обратная транскриптаза, интеграза, протеаза, о которых мы говорили выше). Класс лекарств, нарушающих работу вирусной протеазы, включает большое количество препаратов от достаточно старого лопинавира до современного дарунавира. Основной недостаток препаратов этого класса — высокая степень перекрестной устойчивости: если вирус приобретает устойчивость к одному препарату, скорее всего, на него не подействует ни один другой препарат из этого класса.
На последнем этапе (цифра 7 на схеме) вирусные частицы собираются из готовых компонентов (синтезированных клеткой вирусных белков и РНК), как конструктор, и покидают клетку-хозяина. Лекарств, которые бы тормозили эти процессы, пока не существует.
ВИЧ имеет высокую склонность к мутациям, что позволяет ему быстро приобретать устойчивость к лекарствам. Мутации изменяют форму молекул ферментов вируса. Если при этом форма изменится существенно, то фермент не сможет нормально работать и такой вирус размножаться перестанет — это вредная для вируса мутация. Однако в некоторых случаях — при полезных мутациях — форма молекулы фермента меняется не сильно, а так, что сам фермент продолжает нормально работать, но молекула лекарства уже не может с ним связаться.
Поэтому для эффективного подавления размножения ВИЧ обычно назначают три разных препарата из разных групп, влияющих на разные ферменты вируса, блокируя его воспроизводство на разных этапах. Исключением является группа ингибиторов обратной транскриптазы (НИОТ и ННИОТ) — эти лекарства связываются с разными участками молекулы вирусного фермента, поэтому могут назначаться вместе, несмотря на то, что относятся к одной группе. В условиях такой терапии вирусу очень трудно выработать устойчивость, потому что одновременно должно произойти несколько полезных мутаций в разных генах вируса, а это бывает крайне редко.
Мутации помогают не только ВИЧ, но и некоторым людям. Например, мутация, изменяющая форму рецептора CCR5, который ВИЧ использует на первом этапе проникновения в клетку, делает человека полностью невосприимчивым к некоторым подтипам ВИЧ. Вирус не может «приклеиться» к такому рецептору и проникнуть в клетку. В разных популяциях людей распространенность этой мутации колеблется от 0,1 % до 1 %.
Несмотря на большое количество разных групп препаратов, используемых для торможения ВИЧ-инфекции, вылечить ее полностью пока невозможно. Проблема заключается в том, что все имеющиеся на сегодняшний день лекарства тормозят размножение вирусов в организме на разных этапах, но неспособны полностью удалить вирус из организма. Он всегда будет присутствовать в каком-то количестве клеток в «спящем режиме», встроившись в ДНК, и сразу же продолжит размножение, как только человек прекратит прием антиретровирусных препаратов.
Есть несколько перспективных технологий, например, CRISPR/Cas9, которые могут позволить полностью удалить вирусную ДНК из организма человека, но пока ни одна из них не прошла все необходимые исследования для подтверждения эффективности и безопасности. Исследования продолжаются.





